La cellule - œuf (à l’origine d’un individu), provient de l’association de
l‘ovule (membrane, cytoplasme et noyau) et du noyau du spermatozoïde. Lors de la fécondation seule la tête du spermatozoïde constitué principalement du noyau et de très peu de cytoplasme pénètre dans l’ovule. Le flagelle) reste en dehors.
La cellule-œuf renferme dans un premier temps le noyau du spermatozoïde et celui de l’ovule côte à côte puis les deux fusionnent pour ne former qu’un seul noyau.
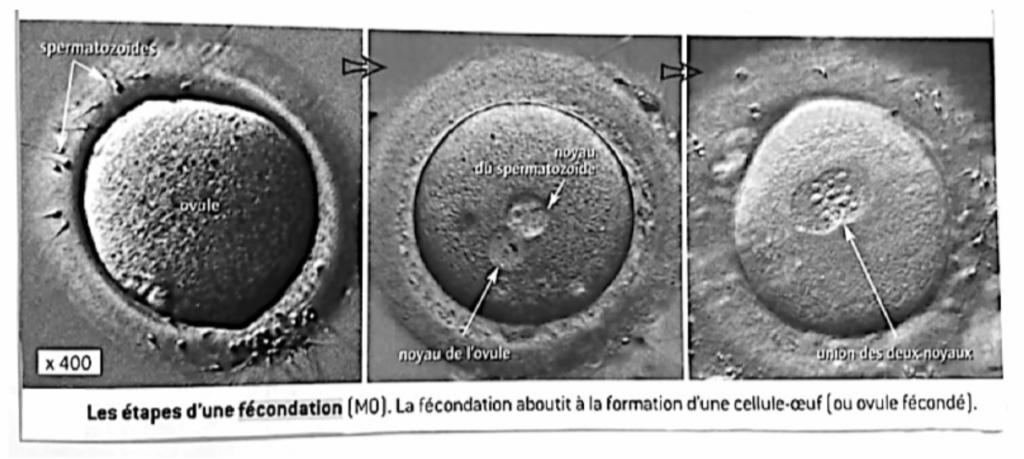
1- Localisation du support des caractères héréditaires dans la cellule.
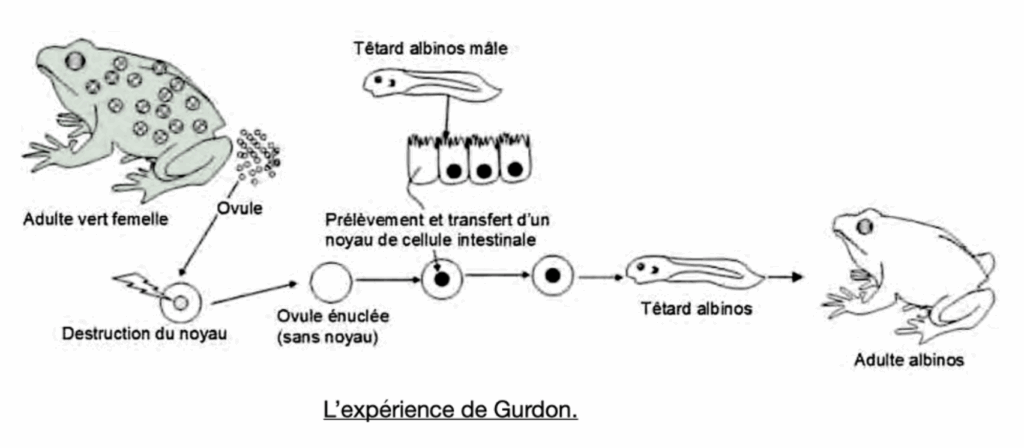
L’observation des étapes de la fécondation révèle qu’il y a fusion des noyaux maternel et paternel. La cellule-oeuf (ou zygote) ne contient plus qu’un noyau. C’est à partir de cette cellule unique que va se développer l’embryon puis le foetus. Plusieurs hypothèses pour déterminer l’origine cellulaire des caractères héréditaires : le noyau, le cytoplasme ou la membrane.
John GURDON, prix Nobel de physiologie en 2012 avait réalisé 40 ans avant le premier clonage d’un mammifère (la brebis Dolly en 1996) un clonage d’amphibien : le Xénope. Le tout premier « vrai » clonage animal ! On voit qu’un ovule énuclée d’un adulte vert (CYTOPLASME + MEMBRANE) dans lequel on transfère un NOYAU d’un cellule intestinale d’un têtard albinos donne adulte albinos. Cet adulte possède donc le caractère de l’individu donneur de noyau. On peut donc en déduire que le caractère « couleur » est contenu dans le noyau des cellules.

2- Rôle des chromosomes contenus dans le noyau.
Les caractères héréditaires sont transmis de génération en génération lors de la reproduction sexuée. Cette information est contenue dans le noyau des cellules.
Quelle est la nature de cette information transmise au cours des générations ?
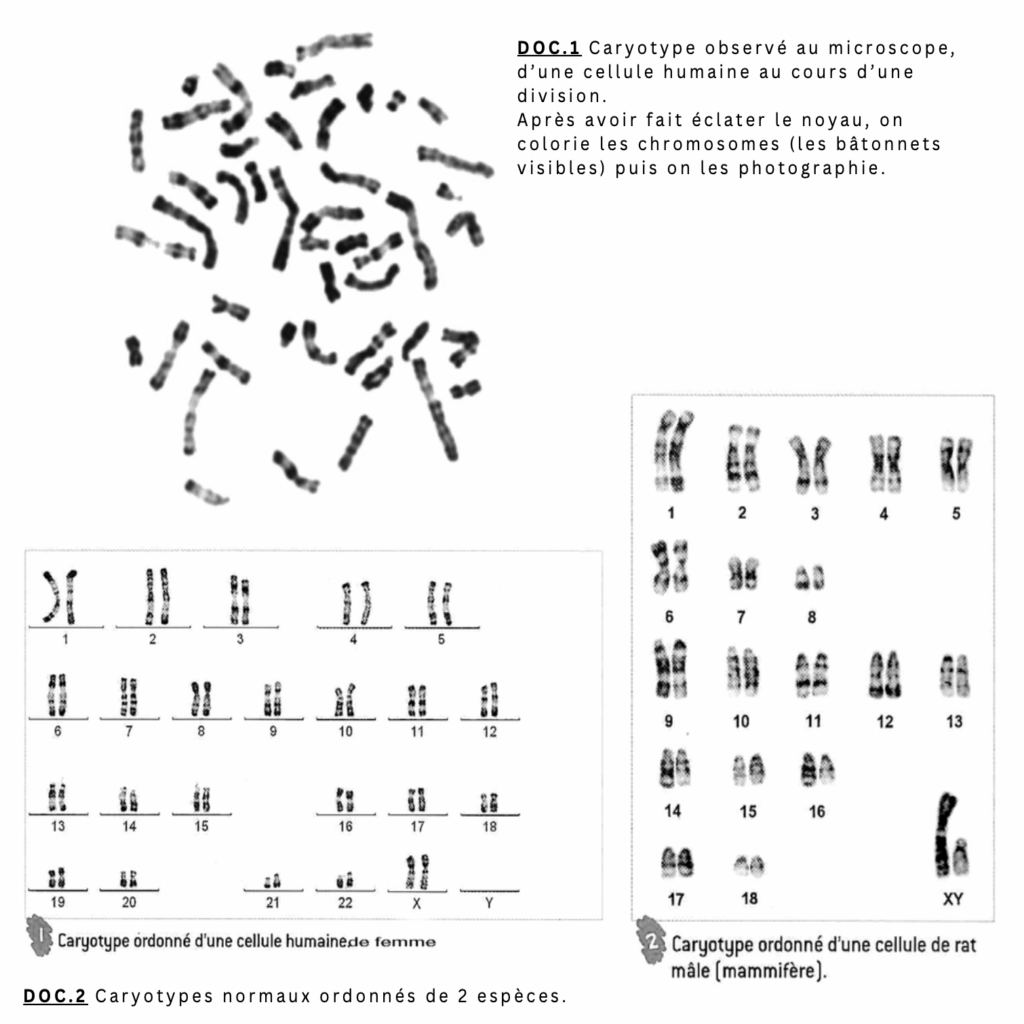

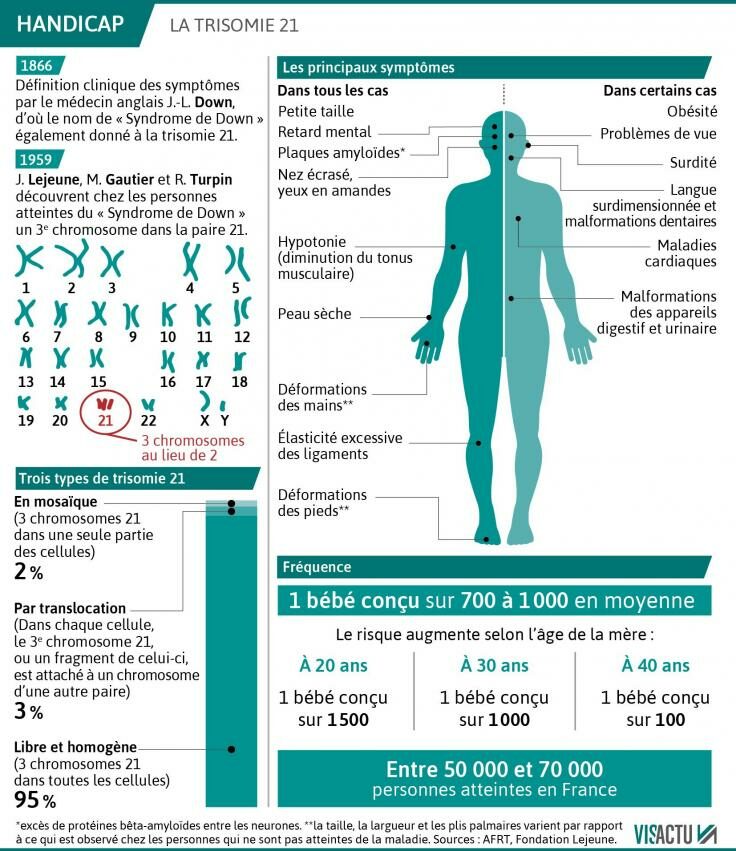
Le caryotype humain (ensemble des chromosomes d’une espèce) renferme 46 bâtonnets visibles sur la photo. Ils sont contenus dans chaque noyau des cellules de l’individu (Doc.1). Ils apparaissent visibles au moment de la division cellulaire. Dans le doc.2, le caryotype est ordonné: les chromosomes sont rangés par paires et par taille (23 paires dans l’espèce humaine, 19 paires pour le rat). On remarque aussi qu’une paire ne porte pas de numéro: chromosomes XX qui définit le sexe féminin et la paire XY qui détermine le sexe masculin: ce sont les chromosomes sexuels.
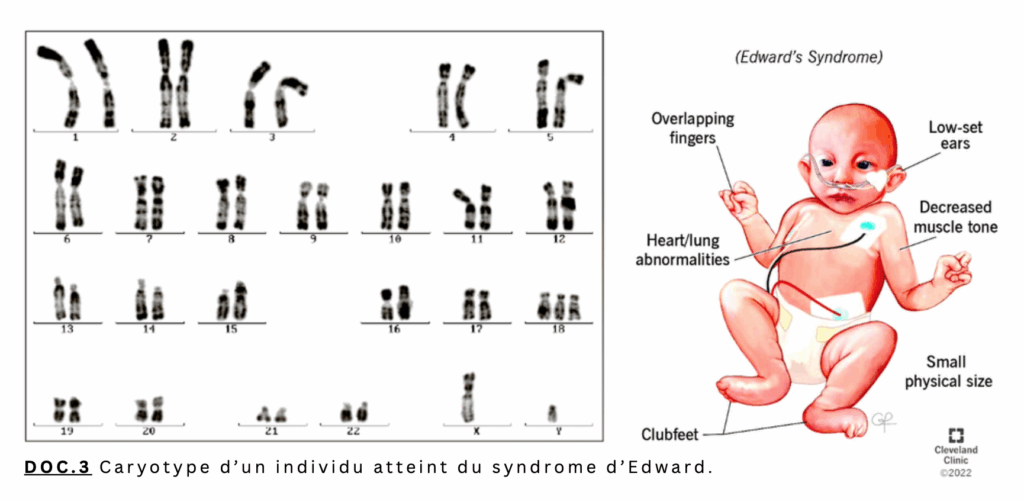
Le doc.3 présente le caryotype ainsi que certains signes cliniques chez un nouveau-né: on note que l’enfant atteint du syndrome d’Edward présente une trisomie 18: un triplet de chromosomes à l’emplacement 18. Les conséquences sont: les doigts de la main qui se croisent « overlapping fingers », une diminution du tonus musculaire « decreased muscle tone », des anomalies au niveau coeur et poumons « heart/lung abnormalities », des pieds-bots « clubfeet »,… La mortalité est très forte avant l’âge d’un an.
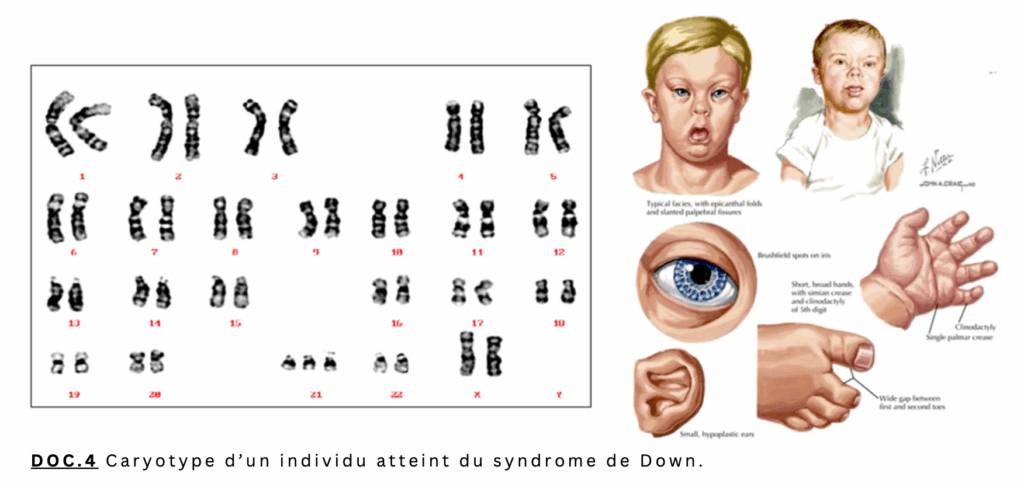
Le doc.4 présente le caryotype ainsi que certains signes cliniques chez un enfant atteint du syndrome de Down: il y a un triplet de chromosomes à l’emplacement 21 (trisomie 21). Les signes de la trisomie 21 évoluent avec l’âge. La tête est petite et ronde avec un visage plutôt aplati et une nuque plate. Les iris, lorsqu’ils sont clairs, peuvent avoir des taches blanches caractéristiques en périphérie (taches de Brushfield). Les mains sont souvent trapues, avec une inclinaison du 5e doigt vers l’intérieur. Les pieds sont, eux aussi, courts, avec un grand espace entre les deux premiers orteils.
Le dépistage de la trisomie 21 dans l’ADN du foetus après une simple prise de sang chez la femme enceinte, nouvelle technique qui vise à diminuer le nombre d’amniocentèses, sera désormais remboursé par l’Assurance maladie, selon un arrêté paru au Journal officiel. Appelée «dépistage prénatal non invasif» (DPNI), cette pratique est officiellement recommandée par la Haute autorité de santé (HAS) depuis mai 2017. Mais on attendait encore la publication des arrêtés permettant son remboursement. Dans les faits, ce test est déjà proposé gratuitement dans les hôpitaux publics de France, grâce à un protocole spécial dédié aux traitements innovants pas encore remboursés. En vertu de l’arrêté publié, le dépistage de la trisomie 21 dans l’ADN du foetus après prise de sang chez la mère figure désormais dans la liste des actes de biologie médicale remboursés. Il coûte environ 390 euros. Un premier arrêté publié le 20 décembre introduisait officiellement cet acte dans le dispositif de dépistage proposé aux femmes enceintes. Jusqu’à présent, le diagnostic prénatal de la trisomie 21 a lieu en deux temps. - D’abord, au premier trimestre de grossesse, on réalise une échographie combinée à une prise de sang pour repérer certains marqueurs de la trisomie. Cela concerne toutes les femmes enceintes. Le résultat de ces premiers examens est exprimé en probabilité de risques. - Si le risque estimé est supérieur à 1/250, on passe à une deuxième étape: le caryotype, l’analyse des chromosomes du foetus, principalement via une amniocentèse (on prélève avec une aiguille du liquide amniotique qui entoure le foetus). Désormais, le test ADN s’intercale entre ces deux étapes: il va être proposé à toutes les femmes enceintes dont le niveau de risque est compris entre 1/1.000 et 1/51 à l’issue des premiers examens. Efficace à plus de 99%, ce test permet d’analyser l’ADN du bébé à partir d’une simple prise de sang chez la mère, via les cellules du foetus qui y sont présentes. Si le test ADN est négatif, l’amniocentèse peut être évitée. Elle reste toutefois indispensable en cas de résultat positif. Le caryotype est le seul moyen d’établir à coup sûr un diagnostic de la trisomie. Mais l’amniocentèse est un examen dit «invasif», et donc potentiellement à risque, car on perfore la membrane entourant le foetus. Selon la HAS ces tests ADN pourraient concerner 58 000 femmes par an sur 800 000 grossesses, soit un surcoût pour la collectivité de 18 millions d’euros. (d'après La voix du Nord- décembre 2018).
BILAN À RETENIR:
Les expériences de transfert de noyau montrent que l'information à l'origine des caractères héréditaires est contenue de la noyau des cellules.
Celui-ci renferme les chromosomes, véritable supports de l'information génétique.
L'ensemble des chromosomes classés d'une espèce désigne son caryotype:
exemple: chien = 78; espèce humaine = 46.
Chaque caryotype est caractéristique d'une espèce, les chromosomes y sont classés par taille et par paire.
Un nombre anormal de chromosomes peut être à l'origine d'anomalies chez l'individu concerné:
exemples: trisomie 21 = retard mental (souvent) + fréquentes maladies cardiaques.
syndrome de Turner (X0) = retard de croissance + stérilité.
